近日,福建医科大学第一附属医院欧启水教授等人于Journal Of Viral Hepatitis 杂志发文,深度论述了乙肝病毒标志物在临床实践中的应用问题。小编将对这篇综述的主要内容做编译整理,以飨读者。

乙型肝炎病毒(HBV)具有独特的生命周期(图1),且易整合到宿主基因组中,这使得研究人员及临床工作者难以分析慢性乙型肝炎的自然病程,预测和评估抗HBV药物疗效以及确定治疗终点。目前学界主要研究的乙肝病毒标志物包括:松弛环状DNA(rcDNA)、共价闭合环状DNA(cccDNA)、HBV RNA、乙型肝炎病毒表面抗原(HBsAg)、乙型肝炎病毒核心抗原(HBcAg)、乙型肝炎病毒核心相关抗原(HBcrAg)。
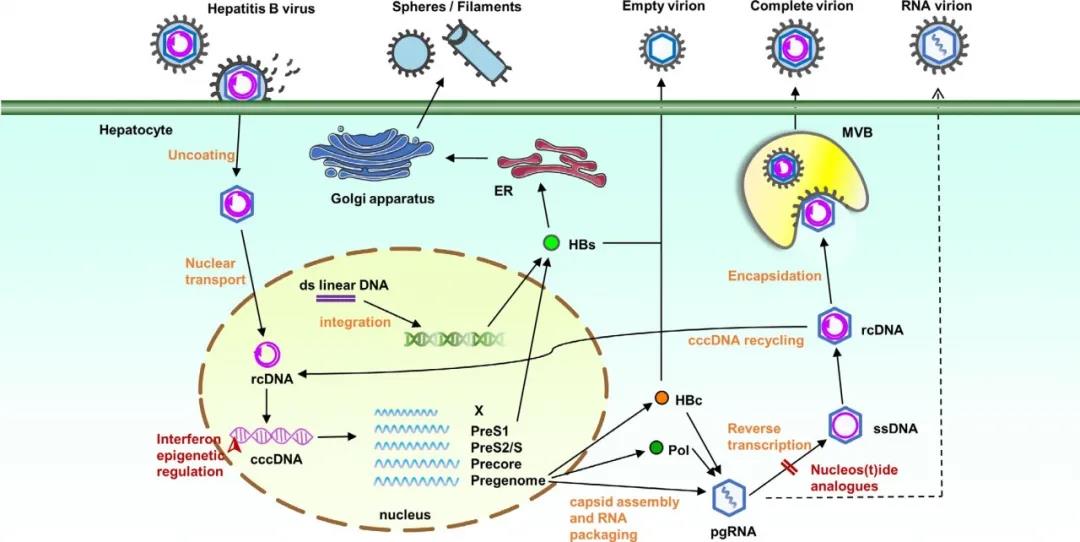
图1 HBV复制周期示意图(Ou Q, et al. 2020)
注:HBV脱壳进入肝细胞后,释放rcDNA入细胞核。rcDNA以双链线性DNA(dslDNA)的形式还原为cccDNA或整合到宿主基因组DNA中。cccDNA经转录合成病毒RNA。前基因组RNA翻译合成HBcAg和聚合酶,然后组装成pgRNA颗粒。pgRNA逆转录合成rcDNA。子代rcDNA核循环完成细胞内cccDNA扩增。PreS1和PreS2/S区编码HBsAg,HBsAg也来自整合的HBV DNA。干扰素影响cccDNA的表观遗传学,下调cccDNA活性,而NAs竞争性地抑制逆转录蛋白,阻断pgRNA逆转录合成rcDNA。
cccDNA=共价闭合环状DNA;ER=内质网;HBc=HBV核心蛋白;MVB=多泡小体;pgRNA=前基因组RNA;Pol=聚合酶;rcDNA=松弛环状DNA;ssDNA=单链DNA。
本文将主要论述上述标志物在预测慢性乙型肝炎活动性和监测治疗应答中的意义,并在此基础上提出了一些实验室诊断中应注意的问题。
01 HBV cccDNA
HBV cccDNA在肝细胞核中呈游离状态,当肝细胞受损时可能出现在血清中。其是唯一的转录模板,指导所有HBV产物的表达并保持乙肝病毒的复制。cccDNA的数量和转录活性对于评估疾病活动性和治疗应答非常重要。在肝细胞核中,由于cccDNA很难被消除,且新的肝细胞可被持续感染,cccDNA池是高度稳定的。在免疫系统不完善且没有治疗药物的情况下,少量cccDNA可能导致大量肝细胞感染HBV或慢性乙型肝炎复发。目前认为,消除或永久沉默cccDNA是慢乙肝长期治疗的最佳策略。
cccDNA位于受感染肝细胞的细胞核中,肝活检是观察其特征的最佳方式。但这种侵入性操作不易被患者接受,并且组织提取物不能代表整个肝脏。自20世纪90年代以来,有多种方法已被用于检测HBV cccDNA,如巢式RT-PCR、嵌合引物RT-PCR(chimeric primer RT-PCR)、侵染检测等。但到目前为止,还未开发出获得广泛认可的HBV cccDNA精确定量方法或商业试剂盒。因此,寻找新的血清标志物来间接反映cccDNA的转录活性,探索更有效的cccDNA检测方法非常重要。
02 HBV RNA
血清HBV RNA是前基因组RNA(pgRNA)释放至细胞外的产物,大小为3.5kb。HBV RNA是HBV DNA负链的逆转录模板。
血清HBV DNA和HBV RNA与慢性HBV感染初治患者的cccDNA显著相关。初治患者血清中HBV RNA约为106 拷贝/mL,HBV DNA约为109拷贝/mL。核苷(酸)类似物(NAs)可抑制HBV DNA的逆转录,故相较于聚乙二醇干扰素α(PegIFNα),经NA治疗后的患者HBV DNA下降更快。相反,NAs不会阻断HBV DNA转录成HBV RNA,因此,随着治疗的持续HBV RNA/HBV DNA的比例可能会增加。当HBV DNA低于检测下限时,可能无法评估cccDNA的状态。在这种情况下,HBV RNA检测可能更有意义,更有利于抗病毒疗效的动态监测。
van Bömmel等人提出,全长型和顿挫型HBV RNA水平的下降可预测在NAs治疗第12周(AUC分别为0.9和0.9)和第24周(AUC分别为0.8和0.85)时的HBeAg血清转换。Wang等人证明了NAs停药时血清HBV RNA阳性与病毒再激活的风险有关。
针对HBV RNA的持续检测不到,Lu等人提出了“前瞻性临床治愈”的概念。他们认为,HBV DNA和HBV RNA同时低于检测限或可作为停止NAs治疗的一个指标。
Wang等人报道,在恩替卡韦治疗后达到病毒学应答的患者中,血清HBV RNA水平与肝内cccDNA水平无相关性,但血清HBV RNA与肝内HBV RNA及肝内HBV RNA/cccDNA比值相关。HBV RNA来源于cccDNA的转录,说明HBV RNA可能反映了cccDNA的转录活性。
经PegIFNα治疗后HBV RNA的下降幅度明显大于NAs,而PegIFNα治疗后获得应答的患者其HBV RNA下降幅度明显大于未应答患者。
Giersch等人曾报道,PegIFNα治疗期间血清HBV RNA和肝内cccDNA之间没有定量关系期间。但van Bömmel等人曾证明,HBV RNA的cut-off值>5.5 log10拷贝/ml可鉴别30%的PegIFNα治疗12周时的无应答患者(阴性预测值为90%)。在这种情况下,HBV RNA或可作为预测PegIFNα疗效的指标。
cccDNA水平不一定与cccDNA的生物学活性一致,因此,虽然HBV RNA与cccDNA水平无相关性,但HBV RNA仍可能反映了cccDNA的活性。
03 乙型肝炎病毒表面抗原(HBsAg)
HBV编码大(LHBsAg)、中(MHBsAg)、小(SHBsAg)三种HBsAg蛋白;这些蛋白质构成了病毒的外壳。除了完整的病毒颗粒之外,过量的HBV表面蛋白可以组成非感染性亚病毒颗粒(SVP)(图2)。
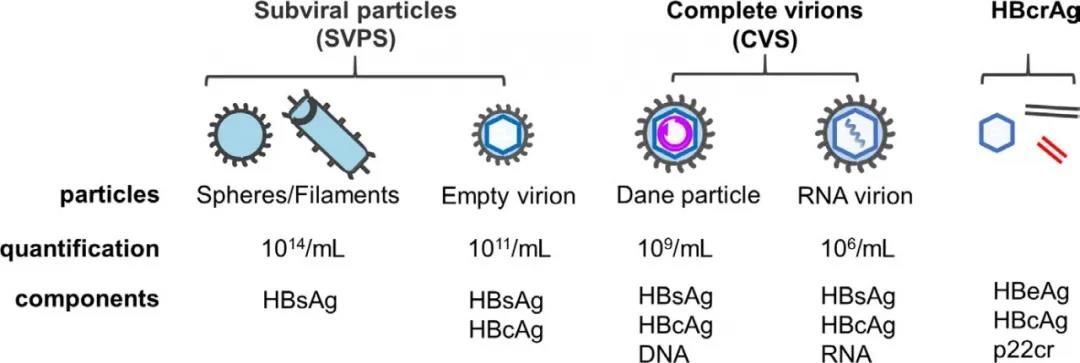
图2 亚病毒颗粒(subviral particles)、完整病毒颗粒(complete virions)和HBcrAg的成分(Ou Q, et al. 2020)
虽然SVP浓度大小(1013 IU/mL)是Dane颗粒(109 IU/mL)的1万倍,但常规检测尚不能明确HBsAg来自于哪种颗粒。
初治CHB患者的血清HBsAg与肝内cccDNA呈正相关。PegIFNα治疗期间,血清HBsAg的动态下降可提示持续的病毒学应答。
然而,在NAs治疗期间,血清HBsAg的动态变化不尽相同。大多数接受NAs治疗的患者血清HBsAg下降缓慢,有些患者甚至需要治疗30多年才能实现HBsAg完全清除。这意味着大多数患者可能需要终生服用NAs药物才能实现功能性治愈。血清HBsAg与肝内cccDNA的相关性存在争议,因为NAs并不直接靶向cccDNA,这使得人们无法预测从cccDNA翻译而来的HBsAg最终是何结局。
影响HBsAg定量预测抗病毒药物疗效准确性的因素主要有:
(1)HBV基因组的DR-1/DR-2区包含S基因及其调控元件,常被整合到宿主基因组中。也就是说,HBsAg不仅来源于cccDNA,还可能源于整合的HBV DNA。HBsAg的双重来源削弱了肝细胞cccDNA与血清HBsAg的相关性,降低了血清HBsAg监测病毒复制的可靠性。
(2)由于S基因的开放阅读框与逆转录酶(RT)基因完全重叠,因此NAs引起的RT基因突变也会改变S基因。而S基因的频繁突变会改变HBsAg的抗原特性,影响HBsAg定量的准确性。
(3)当HBsAg以HBsAg-抗HBs复合物的形式存在时,将无法被检测到。
04 空壳病毒/HBcAg
除了完整的病毒颗粒外,感染HBV病毒的肝细胞还分泌不完整的空壳病毒(Empty virus),即由核衣壳(HBcAg)和包膜(HBsAg)组成的无DNA或无RNA的颗粒。
空壳病毒的产生可以仅由S蛋白诱导,而L蛋白虽不是必需的,但可以促进空壳病毒的分泌,这也可能是空壳病毒(1011 IU/mL)远多于完整病毒(109 IU/mL)的原因之一。
L蛋白也位于空壳病毒的包膜内,通过NTCP受体帮助病毒进入肝细胞,调节HBV再感染,或在细胞外中和抗HBs。
空壳病毒的HBcAg和HBsAg或可反映HBV复制和免疫状态。如前所述,HBsAg来源于cccDNA、整合HBV DNA,而HBcAg仅来源于cccDNA(HBV C基因通常不与宿主基因组整合,不表达HBcAg)。虽然完整病毒也含有HBcAg,但数量上仅为空壳病毒的1%。因此,与HBsAg相比,体现空壳病毒数量的血清HBcAg在评估cccDNA的转录活性方面似乎更有优势。
空壳病毒的分泌似乎不受NAs的影响。在替诺福韦治疗后达到长期病毒学应答的患者中,HBV DNA载量下降但HBcAg(空壳病毒)水平并未下降,这表明空壳病毒的分泌与完整病毒的分泌无关。但可在少数HBsAg清除的患者中观察到空壳病毒的减少,这可能与cccDNA沉默有关。
05 乙肝病毒核心相关抗原(HBcrAg)
HBcrAg由HBV PreC/C基因编码,由HBcAg、HBeAg和22 kDa前核心蛋白(p22cr)组成,共有149个氨基酸序列,HBcrAg的检测就是基于这一序列进行的。
在130例未经治疗的慢乙肝患者中发现,HBcrAg可反映cccDNA的转录活性,因为HBcrAg与总HBV-DNA、cccDNA和pgRNA密切相关。血清HBV DNA无法检出时,HBcrAg仍存在,且与cccDNA相关(R=0.42,P<0.0001)。
HBcrAg>5.7 log10 U/mL是HBeAg血清学转换后HBeAg再次表达的独立预测因子(校正风险比 1.855,P=0.021;95% CI 1.099-3.133)。
在接受PegIFNa治疗的HBeAg阳性患者中,血清HBcrAg(cut-off值为log10 8.0 U/mL)可作为治疗12周时病毒学应答的预测因子(NPV 94.4%)。
HBcrAg在预测PegIFNα治疗应答方面并不优于HBV DNA和HBsAg,但基线HBcrAg联合HBsAg可以预测HBeAg阴性患者的HBsAg清除率(HBsAg≥3.4 log10IU/mL + HBcrAg≥3.7 log10U/mL,NPV 90%)。但需要注意的是,PreC区域和核心启动子的突变可能使HBeAg水平下降甚至清除,我们不知道目前一些研究的受试者队列中是否包含由基因突变引起的HBeAg阴性患者。因此,HBcrAg与cccDNA的相关性分析可能并不是那么可靠。
06 小结
下表总结了文中的病毒标志物在临床中的评估作用。

表1 病毒标志物在NAs和IFNα治疗中的评估作用,以及影响其定量准确性的因素
本文转自“医脉通肝脏科”,编译自:Ou Q , Guo J , Zeng Y , et al. Insights for clinical diagnostic indicators of virus and host in chronic hepatitis B infection[J]. Journal of viral hepatitis, 2020, 27(3):224.
转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。
 电话:01087573022
电话:01087573022
 邮箱:office@igandan.com
邮箱:office@igandan.com
 地址:北京市丰台区南三环西路16号搜宝商务中心3号楼801
地址:北京市丰台区南三环西路16号搜宝商务中心3号楼801
 肝胆相照一家人
肝胆相照一家人


Copyright @ 2014-2021 吴阶平医学基金会肝病医学部 北京肝胆相照公益金会
京ICP备15062285号-1
 京公网安备 11010602022018号
京公网安备 11010602022018号
互联网药品信息服务资格证书:(京)-非经营性-2020-0044